Pesquisar e desenvolver procedimentos inovativos e na fronteira do conhecimento para modelar e simular computacionalmente o sistema cardiovascular humano (SCVH) e suas aplicações na diagnose, tratamento e planejamento cirúrgico de diversas doenças baseada na assimilação de dados e imagens médicas do paciente.
A doença aterotrombótica arterial cardiovascular (DATACV), cujas principais manifestações clínicas são a doença cardíaca isquêmica e o acidente vascular cerebral, é responsável no Brasil, pelo dobro das mortes da segunda causa de óbitos: o grupo “Câncer”. Também é a principal causa de aposentadorias por doença, a principal causa de anos de vida perdidos ajustados por incapacitação, a segunda causa de internações e pelo principal custo destas internações devido principalmente ao uso de procedimentos de alta complexidade e alto custo. Representam, portanto, alta prioridade para o sistema de saúde. O controle não adequado dessas doenças indica que nos faltam conhecimentos sobre a saúde cardiovascular, incluindo o processo de desenvolvimento de placas aterotrombóticas intra-arteriais, e sobre o uso de tecnologias apropriadas para diagnóstico e tratamento. A modelagem computacional do SCVH indica que podemos, através desses modelos, alcançar um melhor entendimento do processo de aterotrombose. Neste sentido a utilização de métodos de imagem, como a ultrassonografia intravascular e a angiotomografia, permitirá a melhoria da modelagem computacional do SCVH, visando sua aplicação nos problemas clínicos de pacientes com este tipo de enfermidades.
Por sua vez, grande parte das hemorragias cerebrais são causadas pela ruptura de aneurismas intra-cranianos, que são dilatações patológicas das artérias cerebrais que aparecem frequentemente na vizinhança do círculo de Willis. Avanços nas imagens médicas têm resultado na detecção de aneurismas não danificados, devendo ser determinadas medidas para seu correto acompanhamento (em particular a implantação de stents e outros dispositivos). Simulações com as características específicas do paciente são necessárias para o planejamento e otimização do dispositivo cujo objetivo é promover a trombose do aneurisma. Informações detalhadas da hemodinâmica nas artérias cerebrais, do tipo das obtidas com simulações como as descritas, são fundamentais também para compreender os mecanismos responsáveis pela iniciação e avanço das doenças cerebrovasculares.
No Laboratório Associado HeMoLab, foi desenvolvido um modelo computacional denominado ADAN (Anatomically Detailed Arterial Network) que incorpora todas as artérias reconhecidas pela literatura especializada (mais de 2000 vasos arteriais) para um paciente masculino de anatomia vascular padrão. Este modelo possui a geometria desenvolvida no espaço 3D, e ainda possibilita simular a propagação do pulso de pressão e a distribuição do fluxo sanguíneo ao longo dos territórios vasculares do corpo humano (mais informações podem ser acessadas ni link http://hemolab.lncc.br/adan-web). Este modelo, mostrado na Figura 1, será a base para o desenvolvimento de várias das atividades propostas a seguir. Na Figura 2 se ilustra o pulso de pressão dado pelo modelo ADAN ao longo do ciclo cardíaco.
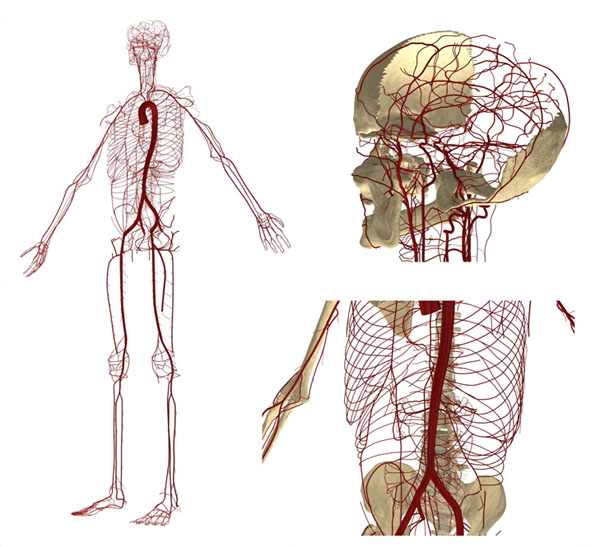
Figura 1. Modelo do sistema arterial anatomicamente detalhado (ADAN Model)
Atividades
- Estudo e desenvolvimento de modelo computacional, anatomicamente detalhado e preciso desde o ponto de vista fisiológico e hemodinâmico (incluindo o desenvolvimento de novos e robustos métodos computacionais para sua solução) da parte venosa do SCVH, e sua incorporação no Modelo ADAN (ver http://hemolab.lncc.br/adan-web).
- Estudo e desenvolvimento de modelos computacionais avançados para representar o comportamento das câmaras cardíacas (átrios e ventrículos) e suas válvulas para, conjuntamente com o modelo ADAN estendido (isto é incorporando a circulação arterial, venosa e pulmonar), estudar o comportamento hemodinâmico do SCVH em condições normais ou alteradas por doenças e ou procedimentos médicos.
- Estudo e desenvolvimento de modelos computacionais avançados para a circulação sanguínea em leitos arteriais periféricos (nível de arteríolas, capilares e vênulas).
- Estudo e desenvolvimento de técnicas computacionais avançadas para a construção automática da topologia e geometria de leitos arteriais periféricos capazes de permitir (i) a incorporação de circulação colateral existentes nestes leitos e (ii) o estudo da microcirculação em tecidos e órgãos como o coração, o fígado e o rim.
Figura 2. Pressão arterial dada pelo modelo ADAN ao longo do ciclo cardíaco.
- Utilizando dados obtidos por técnicas de processamento de imagens médicas de tomografia computadorizada (CT), realizar o estudo e desenvolvimento de modelo computacional avançado customizado ao paciente e anatomicamente detalhado e preciso desde o ponto de vista fisiológico e hemodinâmico da circulação sanguínea coronariana, incluindo efeitos da circulação colateral existentes no miocárdio de maneira a permitir o cálculo computacional não invasivo do FFR (utilizando simplesmente a modalidade CT)
- Utilizando dados obtidos por técnicas de processamento de imagens médicas de ultrassom intravascular (IVUS), e angiografias ortogonais (AX), realizar o estudo e desenvolvimento de modelo computacional para a identificação das propriedades mecânicas dos tecidos possibilitando a histologia computacional in-vivo e consequentemente o desenvolvimento de índices hemodinâmicos associados com a estabilidade (ruptura) de placas de ateroma, auxiliando na diagnose e terapia.
- Estudo e desenvolvimento do modelo 1D+ (isto é formulações variacionais de Galerkin com interpolação híbrida) na modelagem do escoamento sanguíneo em domínios tubulares capazes de competir com o mesmo grau de precisão que os modelos 3D de Navier-Stokes com custo computacional equivalente ao modelo 1D, de forma a acelerar tempos de cálculo de tensões de cisalhamento em paredes arteriais.
- Estudo e desenvolvimento de modelos multi-escala na simulação computacional do comportamento de tecidos biológicos. Empregando formulações variacionais multi-escala, teoria da mecânica dos sólidos em grandes deformações e análise de sensibilidade à mudança de parâmetros associados ao colágeno, elastina e músculo liso e a mudança de forma do distrito arterial, estes modelos permitem simular o surgimento, a evolução e instabilidade (ruptura) de aneurismas e ou placas de ateroma.
- Modelagem e simulação computacional para caracterização e quantificação in vivo de propriedades mecânicas de tecidos biológicos que integram a parede arterial e da cinética de determinadas regiões do músculo cardíaco desenvolvendo, inclusive, índices para auxiliar o diagnóstico e terapia.
- Utilizando dados obtidos por técnicas de processamento de imagens médicas de tomografia computadorizada (CT), realizar o estudo e desenvolvimento de modelo computacional avançado customizado ao paciente e anatomicamente detalhado e preciso desde o ponto de vista fisiológico e hemodinâmico da circulação sanguínea em aneurismas cerebrais, incluindo efeitos da interação sangue-artéria, de maneira a permitir o cálculo computacional não invasivo de índices associados com a estabilidade (ruptura) do aneurisma.
- Pesquisa e avaliação de métodos para quantificação automática de propriedades mecânicas e da cinética de regiões do músculo cardíaco, bem como a sua representação e visualização das informações direcionais extraídas de seqüências 3D dinâmicas multimodalidades (CT, Ressonância Magnética, Ultrassom e Medicina Nuclear), utilizando operadores matemáticos tais como divergente, rotacional e análise de pontos críticos.
- Estudo e desenvolvimento de ferramentas computacionais para realizar experimentos virtuais personalizados de implantação de dispositivos endovasculares em aneurismas cerebrais. Essas ferramentas serão utilizadas para estudar as mudanças hemodinâmicas provocadas por cada possível desenho do dispositivo (stent).
- Desenvolvimento e implementação de um gerador de malhas tridimensionais compostas levando em conta o complexo padrão de bifurcações da árvore arterial, dispositivos implantados no interior das artérias, e todas as especificidades necessárias para simulações por elementos finitos bem sucedidas.
- Desenvolvimento e implementação de condições de contorno para a artérias de saída do modelo matemático do cérebro (que necessariamente deve acabar depois de um certo número de gerações a partir do círculo de Willis). Note-se que são frequentemente muitas centenas de saídas arteriais, cuja pressão é desconhecida. Esse desenvolvimento é fundamental para poder obter resultados fisiologicamente corretos em simulações que incorporem as caraterísticas personalizadas do paciente.
- Aplicação de métodos de inteligência artificial para determinação de pontos característicos no ECG.
- Uma das grandes dificuldades ainda não superada na engenharia de tecidos baseada em bio-impressoras 3D está associada com a sustentabilidade da vida das células depositadas (e geradas) ao redor das estruturas (scaffolds). De fato ao não dispor do sistema vascular para atender o transporte de oxigênio e outros nutrientes e remoção de gás carbônico e resíduos metabólicos todo o processo pode terminar fracassando. Entretanto as atividades 1-8 podem ter papel fundamental na diminuição deste problema. Assim esta atividade procura capacitar a equipe do INCT-MACC para alcançar o conhecimento e a tecnologia necessária na engenharia de tecidos para construção de próteses cardíacas customizadas para paciente-específico, auxiliada através de bio-impressoras 3D baseada em modelagem e simulação computacional de sistemas fisiológicos, incluindo a geração automática dos leitos arteriais e sua simulação hemodinâmica.
Metas
- Até final de 2017: Desenvolver o Sistema ADAN-estendido com a incorporação de todas as artérias e vasos caracterizados pela literatura médica.
- Até final de 2019: Incorporar ao Sistema ADAN-estendido os modelos das câmaras e válvulas cardíacas.
- Até final de 2021: Incorporar ao Sistema ADAN-estendido os modelos de leitos artérias em órgãos e tecidos customizados para o paciente.
- Até final de 2017: Simular o comportamento do SCVH em condições normais ou alteradas por doenças ou intervenções cirúrgicas para auxiliar no diagnóstico, tratamento, prognóstico e planejamento de procedimentos médicos.
- Até final de 2019: Desenvolver a modelagem computacional do sistema coronariano e estabelecer índices computacionais robustos para a avaliação da severidade funcional de uma estenose.
- Até final de 2019: Desenvolver a modelagem computacional de aneurismas cerebrais e estabelecer índices computacionais robustos para a avaliação da severidade funcional dos mesmos e o correspondente risco de ruptura.
- Até final de 2021: Simular computacionalmente diversos procedimentos médicos tais como angioplastias, implantes de stents, clips, anastomoses e pontes.
- Até final de 2021: Simular a difusão de fármacos e outras espécies no sistema cardiovascular humano.
- Até final de 2021: Consolidar o conhecimento na elaboração de próteses cardíacas baseadas em bio-impressoras incluindo a vascularização do tecido.
- Até final de 2017: Desenvolver um conjunto de métodos para quantificação e visualização do movimento cardíaco em imagens de multimodalidades.
- Até final de 2021: Disponibilizar as ferramentas de simulação geradas dentro desse objetivo específico como serviços acessíveis e customizáveis através de interfaces Web (Science gateways).
- Até final de 2019: Disponibilizar um algoritmo imune a artefatos para a detecção de pontos característicos no ECG.
Impactos
- Maior entendimento dos fenômenos hemodinâmicos associados ao estado cardiovascular de um paciente, tanto em condições normais como alteradas por doença ou intervenção humana
- Maior entendimento sobre o início e progresso de doenças cardiovasculares e sua relação com circulação sanguínea
- Possibilidade de análise de consequencias hemodinâmicas pós-operatórias em termos de formas de ondas e de tensões cisalhantes em vasos arteriais e venosos.
- Substituição de estudo intravascular por meio de simulação computacional do risco de infarto de miocárdio (como alternativa ao índice FFR) - Computational Evaluation of Fractional Flow Reserve (CE_FFR)
- Redução na complexidade técnica na avaliação de risco de infarto de miocárdio.
- Redução nos custos operacionais associados com a realização do procedimento médico e permanência pós-operatória.
- Maior entendimento dos mecanismos subjacentes à condição patológica imposta pelos aneurismas cerebrais
- Melhora nos procedimentos de análise de risco de ruptura de aneurismas cerebrais

|
|

